近年来,“相分离”相关研究十分火热,自从Tony A Hyman等人发现相分离现象之后,许多团队对相分离在复杂的生物学过程中所起到的重要作用进行了深入、细致的研究。其中具代表性的工作有普林斯顿的Cliff P. Brangwynne在相分离促进核仁及核仁亚结构的形成方面的工作【1】、德州大学西南医学中心的Michael Rosen关于相分离在膜受体信号转导中的作用的研究【2】、陈志坚教授对固有免疫中cGAS信号通路相分离现象的研究【3】、德国马普所Simon Alberti关于FUS蛋白相分离状态与脊髓侧索硬化症(ALS)疾病进程的关系的研究【4】、伦敦大学伯贝克学院Helen Saibil教授对polyQ肽段相分离与亨廷顿舞蹈症的发病机制的相关研究【5】,以及众多关于相分离的具体发生机制的相关研究。
转录过程中涉及大量的转录聚合酶、转录因子、剪接复合物等分子,这些蛋白内部往往含有一段内源性无序区,构成了其发生相分离的基础条件。,研究转录过程中的“超级增强子”的Whitehead Institute大佬Richard A Young首次提出转录过程中可能有相分离现象的发生【6】。,厦门大学周强教授首先通过实验证明,转录过程中RNA聚合酶Pol II的激酶P-TEFb可通过其组氨酸富集结构域发生相分离、并通过相分离调控转录延伸的活性(Nature丨厦大/UCB周强组揭示相分离对基因转录调控的分子机制——刚柔并济的分子调节及药物开发新理论)【7】。此后,Ricky教授及Robert G Roeder教授实验室联合证明,转录过程中转录因子、转录共激活因子、转录中介复合物、RNA聚合酶Pol II以相分离形式在增强子区域形成“超级增强子”结构,通过从复杂的细胞核中隔离出转录相关组分、调控基因转录的起始阶段【8】。
8月8日, Richard A Young教授课题组在Nature杂志在线发表了最新研究成果Pol II phosphorylation regulates a switch between transcriptional and splicing condensates,该文章对转录过程中Pol II如何与转录中介复合物Mediator解离、从超级增强子处逃逸、开始转录延伸过程、与RNA剪接复合物稳定结合这一转换过程进行了详细的探究,证实Pol II CTD结构域的磷酸化状态是调控这一转换过程的关键。该文章是Rick教授与Phillip A Sharp教授(即1993年因发现内含子而获得诺贝尔生理医学奖者)、Dylan J. Taatjes教授(这位是大名鼎鼎的钱永健教授的博后,钱永健教授是通过改造绿色荧光蛋白使之可呈现彩虹七色,从而改变了细胞生物学的科学家)实验室共同完成的。
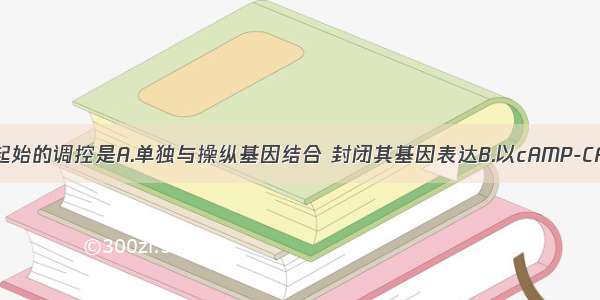
研究者们首先通过免疫荧光和ChIP-seq两个实验证实,在细胞内,低磷酸化状态的Pol II与Mediator在增强子处存在着更多的共定位,而高度磷酸化的Pol II则与RNA剪接复合物的亚基在新生成的RNA处存在着更多的共定位。这一现象可在体外条件下得到重复——Pol II CTD未被磷酸化时,可与Mediator形成相分离现象,而当Pol II CTD被CDK7/9磷酸化后,则这一现象明显减弱。相反,磷酸化后的Pol II CTD可参与到以SRSF2为主所形成的RNA剪接复合物的相分离液滴中,而未被磷酸的Pol II CTD则无此能力。此外,研究者们还通过FRAP等实验来确证这一相分离的液滴性质。
图:Pol II CTD磷酸化状态调控其相分离能力
这一研究表明,Pol II CTD结构域的磷酸化状态调控了其与其他蛋白发生相分离的能力,决定Pol II是停留在增强子区域、还是开始转录延伸过程并促进成熟RNA的形成,Pol II CTD的激酶是调控这一过程的关键。同时,这一研究还提示了蛋白质内源性无序区的磷酸化水平可能是调控该蛋白从一种相分离液滴转移至另一种相分离液滴的关键。
原文链接:
/10.1038/s41586-019-1464-0
参考文献
1. Shin Y, Chang YC, et.al. Liquid Nuclear Condensates Mechanically Sense and Restructure the Genome. Cell. Nov 29;175(6):1481-1491.e13.2. Case LB, Zhang X, et.al. Stoichiometry controls activity of phase-separated clusters of actin signaling proteins. Science. Mar 8;363(6431):1093-1097.3. Du M, Chen ZJ. DNA-induced liquid phase condensation of cGAS activates innateimmune signaling. Science. Aug 17;361(6403):704-709.4. Patel A, Lee HO, et.al. A Liquid-to-Solid Phase Transition of the ALS Protein FUS Accelerated by Disease Mutation. Cell. Aug27;162(5):1066-77.5. Peskett TR, Rau F, O'Driscoll J, et.al. A Liquid to Solid Phase Transition Underlying Pathological Huntingtin Exon1 Aggregation. Mol Cell. May 17;70(4):588-601.e6.6. Hnisz D, Shrinivas K, Young RA, Chakraborty AK, Sharp PA. A Phase SeparationModel for Transcriptional Control. Cell. Mar 23;169(1):13-23.7. Lu H, Yu D, et.al. Phase-separation mechanism forC-terminal hyperphosphorylation of RNA polymerase II. Nature. Jun;558(7709):318-323.8. Sabari BR, Dall'Agnese A et.al. Coactivator condensation at super-enhancers links phase separation and gene control. Science. Jul 27;361(6400). pii: eaar3958.